//pagead2.googlesyndication.com/pagead/js/adsbygoogle.js
(adsbygoogle = window.adsbygoogle || []).push({});
A seguir, resolveremos alguns exercícios referentes a Termodinâmica. Usaremos as equações dos gases ideias e as equações de Transformações Térmicas.
1) Um pneu de bicicleta é calibrado a uma pressão de 4 atm em um dia frio, à temperatura de 7° C. Qual será a pressão de calibração no pneu quando a temperatura atinge 37 ° C ? Considere que a variação de volume do pneu é desprezível.
Resolução:
Com os dados do exercício acima, devemos utilizar a seguinte equação para a resolução do exercício:
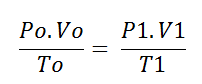
Onde as características do lado esquerdo da equação são os valores iniciais do processo e os da direita são os valores finais das características do gás.
Devemos nos atentar para as unidades do dados. O valor da temperatura deve ser utilizado em Kelvin (K). Portanto, teremos:
To = 7 + 273 = 280 K
T1 = 37 + 273 = 310 K
Como o volume não varia, ele é desconsiderado da equação. Teremos então:
Substituindo os valores, teremos:
Resposta: P1 = 4,43 Atm
2) Você brincou de encher, com ar, um balão de gás, na beira da praia, até um volume de 1 L e fechou. Em seguida, subiu uma encosta próxima carregando o balão, até uma altitude de 900 m, onde a pressão atmosférica é 10 % menor do que a pressão ao nível do mar. Considerando que a temperatura na praia e na encosta seja a mesma, o volume de ar no balão, em L, apos a subida, será de :
Resolução:
Utilizaremos novamente a equação do exercício acima para encontrar o volume, sendo, dessa vez, uma transformação isotérmica, ou seja, a temperatura constante.
Foram nos dados os valores de Vo e V1, mas para encontrar P1 devemos fazer um simples cálculo.
Foi dito que o balão foi lançado da superfície, ou seja, à pressão atmosférica que é igual a 1 atm. Na segunda etapa, a pressão é 10% menor, então:
P1 = 0,9. Po
Portanto, teremos:
Com isso, o valor de V1 será:
Resposta: V1 = 1,11 L
3) Se o volume de um gás a -73° C for reduzido à sua metade num processo isobárico, qual deverá ser a sua temperatura final ?
Resolução:
Nesse caso, temos um processo isobárico, ou seja, a pressão constante.
Assim como no exercício 1, a temperatura deve ser convertida para graus Kelvin, ou seja:
To = -73 + 273 = 200 K
Como o volume foi reduzido a metade, teremos que:
V1 = 0,5.Vo
A equação então fica:
Eliminando Vo dos dois lados da equação, teremos:
Portanto, o valor de T1 será:
Resposta: T1 = 100 K
4) Um gás ocupa um volume de 200 ml , a uma pressão de 380 mmHg a uma temperatura de 27° C. Seu volume nas condições normais de temperatura e pressão será:
Resolução:
Temos que:
Vo = 200 ml
P0 = 380 mmHg
To = 27ºC = 300 K
Nesse caso, todas as características dos gases serão alteradas.
Em particular, nesse exemplo, fomos apresentados às condições normais de temperatura e pressão (CNTP), que são:
P1 = 1 atm = 760 mmHg
T1 = 0 ºC = 273 K
Usando a equação:
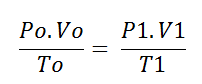
Substituindo os valores que possuímos, teremos:
Portanto, o valor de V1 é:
Resposta: V1 = 91 ml
5) Qual o volume de uma amostra gasosa de 320 g de O2 a 127°C e 1,64 atm ? Considere R = 0,082 (atm.l) (K.mol) e Massa molecular de O = 16 u.a
Resolução:
Nesse exercício, usaremos a equação fundamental dos gases:
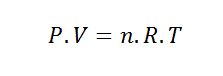
Dados:
P = 1,64 atm
V = ?
T = 127ºC + 273 = 400 K
R = 0,082 (atm.l) (K.mol)
n = m/M = 320/16 = 20 mols
Observação: é importante que as unidades da pressão, temperatura e volume sigam as propriedades da constante R dada, nesse caso, atm,l,K e mols.
Teremos então:
Portanto, V é:
Resposta: V = 400 L
Ficou alguma dúvida, pessoal?
Os exercícios são de simples resolução, mas nós devemos nos atentar às unidades das propriedades.
Sigam nossa página e estudem as aulas relacionadas a Calorimetria:
- Termologia
- Calorimetria
- Calor Latente e Mudanças de Fase
- Exercícios Resolvidos Calorimetria
- Exercícios Resolvidos Calorimetria II
Grande abraço, pessoal!
